- Хімічна термодинаміка.
- Кінетична теорія і статистична термодинаміка.
- Будова молекул і спектроскопія.
- Теорія валентності.
- Хімічна кінетика
ХІМІЯ ФИЗИЧЕСКАЯ, розділ хімії, в якому вивчаються хімічні властивості речовин на основі фізичних властивостей складових їх атомів і молекул. Сучасна фізична хімія - широка міждисциплінарна область, що межує з різними розділами фізики, біофізики та молекулярної біології. Вона має багато спільного і з такими розділами хімічної науки, як органічна і неорганічна хімія.
Відмітна особливість хімічного підходу (на противагу фізичному і біологічному) полягає в тому, що в його рамках, поряд з описом макроскопічних явищ, пояснюється їх природа виходячи з властивостей окремих молекул і взаємодій між ними.
Нові інструментальні та методологічні розробки в галузі фізичної хімії знаходять застосування в інших розділах хімії та суміжних науках, наприклад фармакології і медицині. Як приклади можна привести електрохімічні методи, інфрачервону (ІЧ) і ультрафіолетовій (УФ) спектроскопію, лазерну і магніторезонансну техніку, які широко використовуються в терапії і для діагностики різних захворювань.
Основними розділами фізичної хімії традиційно вважаються: 1) хімічна термодинаміка; 2) кінетична теорія і статистична термодинаміка; 3) питання будови молекул і спектроскопія; 4) хімічна кінетика.
Хімічна термодинаміка.
Хімічна термодинаміка безпосередньо пов'язана із застосуванням термодинаміки - науки про теплоту і її перетвореннях - до проблеми хімічної рівноваги. Суть проблеми формулюється так: якщо є суміш реагентів (система) і відомі фізичні умови, в яких вона знаходиться (температура, тиск, об'єм), то які самовільні хімічні і фізичні процеси можуть призвести цю систему до рівноваги? Перший закон термодинаміки говорить, що теплота є одна з форм енергії і що повна енергія системи (разом з її оточенням) залишається незмінною. Таким чином, цей закон є однією з форм закону збереження енергії. Згідно з другим законом, мимовільно протікає процес призводить до зростання загальної ентропії системи і її оточення. Ентропія - це міра того кількості енергії, яке система не може витратити на вчинення корисної роботи. Другий закон вказує напрямок, яким піде реакція без будь-яких зовнішніх впливів. Щоб змінити характер реакції (наприклад, її напрямок), потрібно затратити енергію в тій чи іншій формі. Таким чином, він накладає суворі обмеження на величину роботи, яка може бути здійснена в результаті перетворення теплоти або хімічної енергії, що виділяються в оборотному процесі.
Важливими досягненнями в хімічній термодинаміці ми зобов'язані Дж.Гіббсом, який заклав теоретичний фундамент цієї науки, яка дала змогу об'єднати в єдине ціле результати, отримані багатьма дослідниками попереднього покоління. В рамках розробленого Гиббсом підходу не робиться ніяких припущень про мікроскопічної структурі матерії, а розглядаються рівноважні властивості систем на макрорівні. Ось чому можна думати, що перший і другий закони термодинаміки носять універсальний характер і залишаться справедливими навіть тоді, коли ми дізнаємося набагато більше про властивості молекул і атомів.
Незважаючи на те що закони хімічної термодинаміки вже встановлені, на макроскопічному рівні термодинаміка - активно розвивається галузь науки. Великий практичний інтерес представляє термодинамічний опис деяких незвичайних хімічних реакцій і систем, а також застосування термодинамічних концепцій до вирішення таких життєво важливих проблем, як отримання енергії, утилізація відходів, використання теплоти, що виділяється в деяких технологічних процесах. У міру того як синтезуються нові хімічні сполуки і на їх основі створюються нові матеріали, виникає необхідність у визначенні їх термодинамічних характеристик (Див. Також ТЕПЛОТА; ТЕРМОДИНАМІКА; ХІМІЧНА ТЕРМОДИНАМІКА) .
Кінетична теорія і статистична термодинаміка.
Які зміни енергії і ентропії в ході хімічних реакцій? Відповідь на це питання дають кінетична теорія і статистична термодинаміка. Згідно кінетичної теорії, все речовини, в якому б стані вони не знаходилися - рідкому, твердому або газоподібному, - складаються з атомів, що знаходяться в постійному русі. У твердих тілах і рідинах атоми так чи інакше пов'язані один з одним, а в газах практично вільні. Термодинамічні властивості систем - рівняння стану (співвідношення, що зв'язують тиск, обсяг, температуру і число атомів), теплоємність, ентропія і інші величини - виводяться з уявлення про те, що рух атомів підпорядковується законам класичної, ньютонівської механіки. Статистична термодинаміка розширює це уявлення, вважаючи, що молекули - основні одиниці матерії - поводяться відповідно до законів квантової механіки, а не класичної фізики. Квантова механіка - це математична теорія, що описує властивості мікросвіту виходячи з припущення про їх імовірнісний характер. Так, фізики говорять не про точний положенні частинки в просторі, а про ймовірність знаходження її в певній області простору. Кінетична теорія і статистична термодинаміка трактують поняття ентропії на молекулярному рівні як міру невпорядкованості системи; цей захід визначається рівнянням Больцмана, 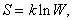 де S - ентропія, k - постійна Больцмана W - число мікроскопічних станів системи (Див. Також РІДИН ТЕОРІЯ; КВАНТОВА МЕХАНІКА) .
де S - ентропія, k - постійна Больцмана W - число мікроскопічних станів системи (Див. Також РІДИН ТЕОРІЯ; КВАНТОВА МЕХАНІКА) .
Статистична термодинаміка (як і квантова механіка) дозволяє передбачити положення рівноваги для деяких реакцій в газовій фазі. За допомогою квантово-підходу вдається описати поведінку складних молекул ряду речовин, що знаходяться в рідкому і твердому стані. Однак існують реакції, швидкість яких не може бути розрахована ні в рамках кінетичної теорії, ні з допомогою статистичної термодинаміки.
Справжня революція в класичній статистичній термодинаміці сталася в 70-х роках 20 ст. Нові концепції, такі, як універсальність (уявлення про те, що члени деяких широких класів сполук мають однакові властивості) і принцип подібності (оцінка невідомих величин виходячи з відомих критеріїв), дозволили краще зрозуміти поведінку рідин поблизу критичної точки, коли зникає різниця між рідиною і газом. За допомогою ЕОМ були змодельовані властивості простих (рідкий аргон) і складних (вода і спирт) рідин в критичному стані. Порівняно недавно властивості таких рідин, як рідкий гелій (поведінка яких прекрасно описується в рамках квантової механіки), і вільних електронів в молекулярних рідинах були всебічно досліджені з застосуванням комп'ютерного моделювання (Див. Також ГЕЛІЙ; надпровідності) . Це дозволило краще зрозуміти властивості звичайних рідин. Комп'ютерні методи в поєднанні з новітніми теоретичними розробками інтенсивно використовуються для вивчення поведінки розчинів, полімерів, міцел (специфічних колоїдних частинок), білків і іонних розчинів. Для вирішення завдань фізичної хімії, зокрема для опису деяких властивостей систем в критичному стані і дослідження питань фізики високих енергій, все частіше застосовується математичний метод ренормалізаціонной групи (Див. Також молекулярно-кінетичної теорії) .
Будова молекул і спектроскопія.
Хіміки-органіки 19 в. розробили прості правила визначення валентності (здатності до об'єднання) багатьох хімічних елементів. Наприклад, вони встановили, що валентність вуглецю дорівнює 4 (один атом вуглецю може приєднати чотири атома водню з утворенням молекули метану CH4), кисню - 2, водню - 1. Виходячи з емпіричних уявлень, заснованих на досвідчених даних, висловлювалися припущення про просторове розташування атомів в молекулах (наприклад, молекула метану має тетраедричних структуру, при цьому атом вуглецю знаходиться в центрі трикутної піраміди, а водень - в чотирьох її вершинах). Однак цей підхід не дозволяв розкрити механізм утворення хімічних зв'язків, а значить, оцінити розміри молекул, визначити точну відстань між атомами.
За допомогою спектроскопічних методів, розроблених в 20 ст., Була визначена структура молекул води (H2O), етану (C2H6), а потім і набагато більш складних молекул, таких, як білки. Методи СВЧ-спектроскопії (ЕПР, ЯМР) і електронної дифракції дозволили встановити довжини зв'язків, кути між ними (валентні кути) і взаємне розташування атомів в простих молекулах, а рентгеноструктурний аналіз - аналогічні параметри для більших молекул, що утворюють молекулярні кристали. Складання каталогів молекулярних структур і використання простих уявлень про валентність заклали основи структурної хімії (піонером її був Л. Полінга) і дали можливість використовувати молекулярні моделі для пояснення складних явищ на молекулярному рівні. Якби молекули не мали певної структури або якби параметри зв'язків C-C і С-H в хромосомах сильно відрізнялися від таких в молекулах метану або етану, то за допомогою простих геометричних моделей Дж.Уотсон і Ф. Крик не змогли б побудувати на початку 1950-х років свою знамениту подвійну спіраль - модель дезоксирибонуклеїнової кислоти (ДНК). Досліджуючи методами ІЧ і УФ-спектроскопії коливання атомів в молекулах, вдалося встановити природу сил, що утримують атоми в складі молекул, що, в свою чергу, навело на думку про наявність внутримолекулярного руху і дало змогу дослідити термодинамічні властивості молекул (див. Вище). Це був перший крок до визначення швидкостей хімічних реакцій. Далі, спектроскопічні дослідження в УФ-області допомогли встановити механізм утворення хімічного зв'язку на електронному рівні, що дозволило описувати хімічні реакції, грунтуючись на уявленні про перехід реагентів в збуджений стан (часто під дією видимого чи УФ-світла). Виникла навіть ціла наукова галузь - фотохимия. Спектроскопія ядерного магнітного резонансу (ЯМР) дала можливість хімікам досліджувати окремі стадії складних хімічних процесів і ідентифікувати активні центри в молекулах ферментів. Цей метод дозволив також отримати тривимірні зображення інтактних клітин і окремих органів. Див. Також МАГНІТНИЙ РЕЗОНАНС; Фотохімії.
З початку 1960-х років використання нового методу - лазерної спектроскопії - дозволило підвищити чутливість спектроскопических методів до 10-12 с. В результаті з'явилися нові частотні і тимчасові стандарти (Див. Також ЛАЗЕР) . Висока інтенсивність і строго певна частота лазерного випромінювання дозволили детально вивчати енергетичні стану молекул. Використовуючи ультракороткі імпульси, можна досліджувати молекулярні процеси, які протікають за час порядку пико- і фемтосекунд, - саме за такий час відбуваються розрив хімічних зв'язків між окремими атомами і утворення нових (одна пікосекунди дорівнює 10-12 с, а одна фемтосекунда - 10-15 с). Із застосуванням такої техніки можна досліджувати хімічні реакції на високому рівні дозволу і зафіксувати освіту і зміна конформації таких життєво важливих макромолекул, як нуклеїнові кислоти. Більш того, вивчаючи характер «відповіді» окремої молекули на інтенсивний імпульс, можна отримати цінну інформацію про сили, що діють в мікросвіті. Нові спектроскопічні методи, використання молекулярних і іонних пучків в якості зондів, а також успіхи фізики низьких температур дозволяють «побачити» всі більш і більш дрібні структурні утворення. Вдалося всебічно досліджувати слабкі внутрішньо- і міжмолекулярні взаємодії в таких системах, як кристали графіту (Див. Також МОЛЕКУЛ СТРОЕНИЕ; СПЕКТРОСКОПІЯ) .
Теорія валентності.
Використовуючи емпіричні правила валентності, розроблені хімік-органік, періодичну систему елементів і планетарну модель атома Резерфорда, Г.Льюіс встановив, що ключем до розуміння хімічного зв'язку є електронна структура речовини. Льюїс прийшов до висновку, що ковалентний зв'язок утворюється в результаті усуспільнення електронів, що належать різним атомам; при цьому він виходив з уявлення про те, що зв'язують електрони перебувають на строго певних електронних оболонках. Квантова теорія дозволяє передбачити структуру молекул і характер утворюються ковалентних зв'язків в найзагальнішому випадку (Див. Також ХІМІЯ) .
Наші уявлення про будову речовини, що сформувалися завдяки успіхам квантової фізики в першій чверті 20 ст., Можна коротко викласти так. Структура атома визначається балансом електричних сил відштовхування (між електронами) і тяжіння (між електронами і позитивно зарядженим ядром). Майже вся маса атома зосереджена в ядрі, а його розмір визначається обсягом простору, зайнятого електронами, які обертаються навколо ядер. Молекули складаються з відносно стабільних ядер, утримуваних разом швидко рухомими електронами, так що всі хімічні властивості речовин можна пояснити виходячи з уявлення про електричний взаємодії елементарних частинок, з яких складаються атоми і молекули. Таким чином, головні положення квантової механіки, що стосуються будови молекул і утворення хімічних зв'язків, створюють основу для емпіричного опису електронної структури речовини, природи хімічного зв'язку і реакційної здатності атомів і молекул (Див. Також АТОМ) .
З появою швидкодіючих обчислювальних машин вдалося розрахувати (з невисокою, але достатньою точністю) сили, що діють між атомами в малих багатоатомних молекулах. Теорія валентності, яка спирається на комп'ютерне моделювання, в даний час є робочим інструментом для досліджень структур, природи хімічних сил і реакцій в тих випадках, коли проведення експериментів утруднено або вимагає великих витрат часу. Це відноситься до дослідження вільних радикалів, присутніх в атмосфері і полум'я або утворюються як проміжні продукти реакцій. Є надія, що коли-небудь теорія, яка спирається на комп'ютерні розрахунки, зможе відповісти на питання: яким чином за час порядку пикосекунд хімічні структури «вираховують» своє найбільш стабільний стан, тоді як для отримання відповідних оцінок хоч в якомусь наближенні потрібна величезна кількість машинного часу.
Хімічна кінетика
займається вивченням механізму хімічних реакцій і визначенням їх швидкостей. На макроскопічному рівні реакцію можна представити у вигляді послідовних перетворень, в ході яких з одних речовин утворюються інші. Наприклад, здається простим перетворення
H2 + (1/2) O2 → H2O
насправді складається з декількох послідовних стадій:
H2 → 2H
H + O2 → OH + O
O + H2 → HO + H
H + O2 → HO2
HO2 + H2 → H2O + OH
і кожна з них характеризується своєю константою швидкості k. С.Арреніус припустив, що абсолютна температура T і константа швидкості реакції k пов'язані співвідношенням k = A exp (- E акт) / RT, де А - предекспоненціальний множник (т.зв. частотний фактор), Е акт - енергія активації, R - газова стала. Для вимірювання k і Т потрібні прилади, що дозволяють відслідковувати події, які відбуваються за час порядку 10-13 с, з одного боку, і за десятиліття (і навіть тисячоліття) - з іншого (геологічні процеси); необхідно також вміти вимірювати мізерно малі концентрації надзвичайно нестабільних реагентів. В задачу хімічної кінетики входить, крім того, прогнозування хімічних процесів, що протікають в складних системах (мова йде про біологічні, геологічні, атмосферних процесах, про горіння і хімічному синтезі).
Для дослідження газофазних реакцій «в чистому вигляді» застосовують метод молекулярних пучків; в цьому випадку молекули зі строго визначеними квантовими станами реагують з утворенням продуктів, теж знаходяться в певних квантових станах. Такі експерименти дозволяють отримати інформацію про силах, що обумовлюють протікання певних реакцій. Наприклад, в молекулярно-пучкової установці можна орієнтувати заданим чином навіть такі малі молекули, як CH3I, і виміряти швидкості зіткнення в двох «різних» реакціях:
K + ICH3 → KI + CH3
K + CH3I → KI + CH3
де CH3-група орієнтована по-різному щодо наближається атома калію.
Одне по вопросам, Яким займається фізична хімія (а такоже хімічна фізика), - розрахунок констант швидкости Реакції. Тут широко застосовується розроблено в 1930-х роках теорія перехідного стану, в Якій Використовують термодінамічні та структурні параметрами. Ця теорія в поєднанні з методами класичної фізики та квантової механіки дозволяє моделювати хід реакції, як якщо б вона протікала в умовах експерименту з молекулярними пучками. Проводяться досліди по лазерному порушення певних хімічних зв'язків, що дозволяють перевірити правильність статистичних теорій деструкції молекул. Розробляються теорії, узагальнюючі сучасні фізичні та математичні концепції хаотичних процесів (наприклад, турбулентності). Ми вже не так далекі від того, щоб до кінця зрозуміти природу як внутрішньо-, так і міжмолекулярних взаємодій, розкрити механізм реакцій, що протікають на поверхнях із заданими властивостями, встановити структуру каталітичних центрів ферментів і комплексів перехідних металів. Що стосується мікроскопічного рівня, можна відзначити роботи по вивченню кінетики освіти таких складних структур, як сніжинки або дендрити (кристали з деревовидної структурою), які стимулювали розвиток комп'ютерного моделювання, заснованого на простих моделях теорії нелінійної динаміки; це відкриває перспективи створення нових підходів до опису будови і процесів розвитку складних систем. Див. Також БІОХІМІЯ; біофізики; ХІМІЇ ІСТОРІЯ; КРИСТАЛИ І кристалографії; ФІЗИКА; РОЗЧИНИ; Надплинності.
Які зміни енергії і ентропії в ході хімічних реакцій?